- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Paano gumagana ang mga baterya ng vanadium?
2025-04-08
Ano ang mga sangkap ng isang baterya ng vanadium?
Kung ito ay isangSistema ng Pag -iimbak ng Enerhiyao a Sistema ng Eksperimentong Laboratory, Ang mga baterya ng daloy ng vanadium ay pangunahing binubuo ng mga sumusunod na pangunahing sangkap:
Vanadium Stack: May kasamang maraming mga cell, na responsable para sa pag -convert ng elektrikal na enerhiya.
Mga tanke ng electrolyte: Store ang mga electrolyte na batay sa vanadium para sa mga positibo at negatibong mga electrodes, na karaniwang naglalaman ng mga ion ng vanadium sa apat na estado ng oksihenasyon.
Pump & Piping: Ginamit upang paikot ang mga electrolyte upang gawin itong daloy sa salansan.
Ion Exchange Membrane: Matatagpuan sa pagitan ng mga positibo at negatibong mga electrodes, na nagpapahintulot sa mga proton na pumasa ngunit pinipigilan ang cross-kontaminasyon ng electrolyte.
Paano gumagana ang mga baterya ng daloy ng vanadium
Ang pag -iimbak ng enerhiya at pagpapakawala ng mga baterya ng daloy ng vanadium ay batay sa multivalent redox reaksyon ng mga elemento ng vanadium. Ang pinakamalaking tampok nito ay ang parehong positibo at negatibong mga electrodes ay gumagamit ng mga ion ng vanadium, ngunit sa iba't ibang mga estado ng oksihenasyon, upang makamit ang isang matatag at mababalik na proseso ng electrochemical.
1. Komposisyon ng Electrolyte
Ang baterya ng daloy ng vanadium redoxGumamit ng mga electrolyte na natutunaw ng tubig na sulfate, kung saan umiiral ang mga ion ng vanadium sa sumusunod na apat na estado ng oksihenasyon:
Positibong bahagi ng elektrod:
Vo²⁺ (v⁴⁺)
Vo₂⁺ (v⁵⁺)
Negatibong panig ng elektrod:
V³⁺
V²⁺
Ang mga ion na ito ay na -convert sa pamamagitan ng mababalik na reaksyon ng redox sa panahon ng proseso ng singil at paglabas upang makamit ang pag -iimbak ng enerhiya at pagpapakawala.
2. Proseso ng pagsingil
Kapag ang isang panlabas na mapagkukunan ng kapangyarihan (tulad ng isang solar inverter, grid, atbp.) Ay nagbibigay ng kapangyarihan sa system, ang electrolyte ay "isinaaktibo" saVanadium StackAt naganap ang mga sumusunod na reaksyon:
Positibong reaksyon ng elektrod (oksihenasyon):
Vo + + h₂o → vo₂⁺ + 2h⁺ + e⁻
→ Ang V⁴⁺ ay na -oxidized sa V⁵⁺, naglalabas ng mga electron.
Negatibong reaksyon ng elektrod (pagbawas):
V³⁺ + E⁻ → V²⁺
→ V³⁺ ay nabawasan sa V²⁺, sumisipsip ng mga elektron.
Migration ng Ion:
Ang mga electron ay dumadaloy mula sa positibong elektrod hanggang sa negatibong elektrod sa pamamagitan ng panlabas na circuit, ang mga ion ng hydrogen ay pumapasok sa negatibong silid ng elektrod mula sa positibong silid ng elektrod sa pamamagitan ng palitan ng lamad, at ang panlabas na kasalukuyang direksyon ay mula sa negatibong elektrod hanggang sa positibong elektrod.
3. Proseso ng paglabas
Idiskonekta ang panlabas na supply ng kuryente, nagsisimula ang system na magbigay ng kapangyarihan sa pag -load, at kabaligtaran ang direksyon ng reaksyon:
Positibong reaksyon ng elektrod (pagbawas):
Vo₂⁺ + 2h⁺ + e⁻ → vo + + h₂o
→ Ang V⁵⁺ ay nabawasan pabalik sa V⁴⁺, sumisipsip ng mga electron.
Negatibong reaksyon ng elektrod (oksihenasyon):
V²⁺ → V³⁺ + E⁻
→ V²⁺ ay na -oxidized pabalik sa V³⁺, naglalabas ng mga electron.
Kasalukuyang output:
Ang mga electron ay dumadaloy mula sa negatibong elektrod hanggang sa positibong elektrod sa pamamagitan ng panlabas na circuit, ang mga ion ng hydrogen ay pumapasok sa positibong silid ng elektrod mula sa negatibong silid ng elektrod sa pamamagitan ng palitan ng lamad, at ang panlabas na kasalukuyang direksyon ay mula sa positibong elektrod hanggang sa negatibong elektrod.
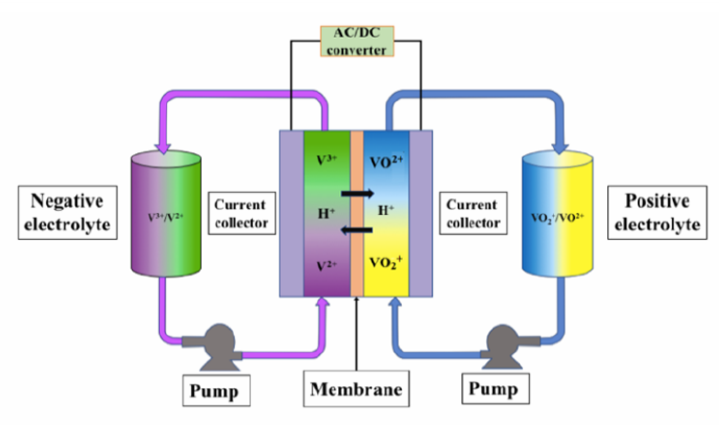
Eskematiko diagram ng istraktura ng baterya ng daloy ng likidong vanadium
Ano ang mga katangian at katangian ng vanadium?
Mataas na kaligtasan: Ang electrolyte ay hindi nasusunog, ang reaksyon ay matatag, at ang thermal runaway ay bihirang mangyari.
Ultra-long cycle life: Halos walang pagkasira ng pagganap pagkatapos ng libu -libong mga singil at paglabas ng mga siklo.
Independiyenteng disenyo ng enerhiya at kapangyarihan: Ang lakas ng stack o kapasidad ng electrolyte ay maaaring mapalawak nang hiwalay ayon sa mga pangangailangan.
Madaling mapanatili at subaybayan: Ang modular na istraktura ay angkop para sa pang -agham na pananaliksik at mga aplikasyon sa pagtuturo.
Friendly at recyclable sa kapaligiran: Ang vanadium electrolyte ay maaaring magamit muli nang paulit -ulit, na nakakatugon sa mga pangangailangan ng napapanatiling pag -unlad.
Ano ang mga aplikasyon ng baterya ng daloy ng vanadium?
1. Pag -iimbak ng enerhiya para sa nababagong enerhiya
2. Pag-iimbak ng Enerhiya ng Pang-industriya at Park-Level
3. Regulasyon ng Grid at Microgrid
4. Mga layunin ng Laboratory at R&D
Maliit na mga sistema ng baterya ng vanadiumMaaaring magamit para sa mga demonstrasyon sa pagtuturo, bagong materyal na pag -verify, at pananaliksik sa electrochemical.
Maaaring sisingilin at mailabas nang paulit-ulit, angkop para sa pangmatagalang pagsubok sa katatagan.
5. Mga istasyon ng base ng komunikasyon at malayong imprastraktura
Interesado na matuto nang higit pa?
Makipag -ugnay sa aming koponan ng mga eksperto sa pag -iimbak ng enerhiya ngayon. Masaya kaming talakayin ang iyong mga kinakailangan sa imbakan at tulungan kang masuri kungMga baterya ng daloy ng vanadiumay tama para sa iyong proyekto.

